I. PROPIEDADES FISICOQUÍMICAS DEL AGUA.
Resolver los siguientes cuestionamientos:
1. ¿Cuál es la importancia biológica del agua?.
El agua es una sustancia de capital importancia para la vida con excepcionales propiedades consecuencia de su composición y estructura.
Es una molécula sencilla formada por tres pequeños átomos, uno de oxígeno y dos de hidrógeno, con enlaces polares que permiten establecer puentes de hidrógeno entre moléculas adyacentes. Este enlace tiene una gran importancia porque confiere al agua propiedades que se corresponden con mayor masa molecular
De ahí sus elevados puntos de fusión y ebullición, imprescindibles para que el agua se encuentre en estado líquido a la temperatura de la Tierra.
Su alto calor específico la convierte en un excepcional amortiguador y regulador de los cambios térmicos, manteniendo la temperatura corporal constante.
2. ¿En qué consiste el término solubilidad?.
Las soluciones son mezclas homogéneas de dos o más sustancias puras. Para nuestros propósitos, discutiremos soluciones con un solo soluto y agua como solvente. ¿Qué es un solvente? En términos más crudos, es la molécula en la mezcla con la concentración más alta. Es decir si tuvieras un litro de sal y 2 gramos de agua. En ese caso, la sal sería el solvente y el agua el soluto. Pero este tipo de mezcla sería inútil, ¿por qué molestarse en hacerlo?
Cuando hacemos solutos y solventes juntos, existe lo que llamamos el proceso de solución. Puede pensar que es similar a lo que experimentaría si intentara meterse en un ascensor ya lleno. Todo el mundo tiene que adaptarse para "encontrar su espacio" de nuevo. Ahora, al igual que en el ascensor, las moléculas se ajustarán de manera diferente según el tipo de molécula que haga una entrada. Y también como en un ascensor, llegará el momento en que no se puedan agregar más personas. Para una solución, este punto se llama punto de saturación y la solución en sí se llama solución saturada. En el punto de saturación, ya no se disolverá más soluto en el solvente. Más bien, el proceso de disolución y precipitación se producen simultáneamente y al mismo ritmo.
3. Explique las propiedades fisicoquímicas del agua.
Como componente de las sustancias orgánicas e inorgánicas, así como en su función como medio de reacción, reacción y transporte, el agua es esencial para todos los procesos abióticos y bióticos en la Tierra. Debido a su capacidad para formar enlaces de hidrógeno intermoleculares, el agua posee una gama de propiedades fisicoquímicas particulares que son de importancia fundamental para los presupuestos de materia y energía de los ecosistemas.
Estas son algunas de las propiedades de este elemento, algunas de ellas, altamente conocidas, la mayoría de las personas y otras técnicas y menos tenidas en cuenta.
1. Es incolora
Si bien cuando vemos el mar o un río nos puede parecer que el agua puede tener un color azulado-verdoso oa veces amarronado, se debe a la manera en que responde la luz y se absorbe con mayor facilidad longitudes de onda cortas (con lo que resulta más sencillo que a nuestros ojos, en tonalidades azuladas). Sin embargo, no podemos percibir en ella ningún color, siendo transparente para nuestra vista.
2. No tiene sabor ni olor.
El agua es una sustancia que, al contrario que otras, no posee por sí mismo un mismo sabor o olor. En el caso de que el agua nos sepamos algo porque ha sido adulterada de alguna forma (por ejemplo, añadiéndole saborizantes) o porque al llegar a nosotros ha arrastrado otras personas
elementos (por ejemplo frutas u otros alimentos, minerales, cal, plástico o contaminantes) ).
3. Se encuentra en la naturaleza en los tres estados.
Existen muchas sustancias que son complicadas de encontrar en la naturaleza más allá del estado concreto de la materia. Sin embargo, en el caso del agua podemos ver fácilmente en cualquiera de los estados: el agua líquida de los yeguas, los ríos y la lluvia, en la forma gaseosa puede observarse como el vapor del agua y la forma del corazón de la lluvia.
4. Posee una temperatura de transformación fija.
A pesar de que el agua puede ser mezclado con otras sustancias, lo que es lo que es un nivel físico puede contemplar cómo este elemento siempre se evapora o se congela a la misma temperatura, con un punto de congelación a los 0ºC y de ebullición a Los 100ºC.
5. Compuesto y no elemento
Aunque se ha encontrado una fórmula química, H2O, no se ha antepuesto. Dos átomos de hidrógeno unidos a un átomo de oxígeno.
6. Es una lista
Tal vez la palabra se traduce como un nivel más popular. Y es que muchas sustancias se disuelven en contacto con H2O, siendo el agua capaz de cambiar su estructura y propiedades.
De hecho, es una tarea casi universal de sustancias polares, como el alcohol o las ventas. Fuera de las reacciones químicas del laboratorio, esta propiedad resulta indispensable para explicar, por ejemplo, el funcionamiento de las células vivas de nuestro organismo.
Quizás te interese: "Los 5 tipos de enlaces químicos: así se compone la materia"
7. Posee una carga eléctrica neutra.
Los átomos de una molécula de agua tienen una carga eléctrica neutra, aunque no tienen que decir que sus componentes no tienen una carga sino que por lo general se encuentra equilibrada. Por lo general, cada molécula consta con una decena tanto de protones como de electrones, que se concentran cerca del oxígeno. Así, alrededor de la energía eléctrica es más positiva.
8. Densidad estable
De igual forma, los puntos de congelación y ebullición suelen ser archivos, el agua también se maneja para mantener una densidad muy estable en su situación ambiental. Un agua pura y sin ningún otro componente (es decir, destilada) tiene una densidad de 1 kg / l.
Sin embargo, normalmente hay una densidad de 0,997-0,998 kg / l. En el caso del hielo, su densidad suele ser de 0,917 Kg / l.
9. Difícil de comprimir
Comprender un volumen de agua es altamente complejo (si bien no imposible), dado que se trata de un nivel de cohesión (es decir, de una manera fuerte de mantener unidas entre sí).
10. Se adhiere
El agua moja. Esta es la forma de adherirse a otras superficies y materiales.
11. Baja conductividad eléctrica.
Probablemente hayamos escuchado en alguna ocasión de alguien que ha muerto. Como la mayoría sabe, este tipo de accidentes es algo muy real y peligroso.
Sin embargo, hay que tener en cuenta que el responsable en sí no es realmente el agua, sino las diferentes ventas y otros componentes que lleva con ella. De hecho, el agua destilada o pura no es la conducta de la electricidad sino el aislamiento, dado que no posee electrones libres que puedan conducirla.
Ahora bien, es importante remarcar que estamos hablando de agua destilada en la que no hay nada más que las fuentes de agua: el agua que bebemos, con la que nos duchamos y bañamos y los que encontramos en los ríos y las yeguas. contiene una gran cantidad de minerales y otros componentes con potencial conductor.
12. Ph relat neutro
Otra característica del agua es que en general y por el término medio a menudo tienen un pH neutro o casi neutro, oscilando su pH entre 6,5 y 8,5 (un pH totalmente neutro sería de 7). Esto implica que, en general, el agua puede ser la ácida o la técnica básica, pero siempre que se manipule el grado de acidez o se mezcle con las otras sustancias.
13. Participa en múltiples reacciones químicas.
Otro aspecto es tener en cuenta el agua es un aumento en el nivel de interacción con otros elementos, de esta manera se producen diferentes reacciones químicas y se forma parte de diferentes procesos o sustancias.
Por ejemplo, como ya hemos visto, es capaz de disolver sustancias polares, así como de reaccionar con óxidos básicos y ácidos para formar compuestos como el hidróxido de calcio o ácido sulfúrico. También puede generar diversas reacciones sobre diversos tipos de metales, y participaciones en procesos como la oxidación o la creación de hidratos.
14. Elevada tensión superficial.
Esta propiedad hace referencia a la fuerza necesaria para vencer a la fuerza de la atención.
Su elevado valor (En el caso del agua tiene un valor de 72,8 dina / cm) hace que por lo general cuando estamos ante una superficie de agua en esta tienda es estable, algo que es difícil romper su forma sino se aplica una fuerza considerable. Es por eso que las hojas u otros objetos suelen flotar para generar una alteración excesiva en la forma de la superficie.
15. Regula la temperatura
Otra interesante y conocida propiedad del agua es su capacidad para regular la temperatura. Y es que el agua es capaz de retener el calor, algo que provoca que se enfríe más lentamente que otras sustancias. Asimismo, también tarda más en calentarse. Un ejemplo lo vemos en el efecto que tiene el mar sobre la temperatura de la costa, por lo general más moderado que en el interior.
4. ¿Cómo se genera la solubilidad de solutos iónicos en el agua?.
En muchos líquidos polares, como el agua, son buenos disolventes para sustancias iónicas, o en general, sustancias covalentes polarizadas. En cambio, no son buenos disolventes para sustancias no polares, siendo estas la gran mayoría de las sustancias covalentes.
Para poder explicar de manera cuantitativa la capacidad de las distintas sustancias para disolverse en disolventes del tipo del agua, se ha enunciado el concepto de solubilidad, el cual explica que la solubilidad de un soluto en un disolvente, hace referencia a la cantidad máxima de dicho soluto que se pueda disolver en una cantidad concreta de disolvente o de disolución a una cierta temperatura
5. ¿Cómo se genera la solubilidad de solutos no polares en el agua?.
algunas sustancias bioquímicas,
en su estructura naturaleza iónica y al mismo tiempo no polar, estas
sustancias se conocen usualmente como anfipáticas o anfilílicas (amphi, ambos extremos, y philic, afinidad)
Por ejemplo, los ácidos grasos contienen en su estructura cadenas carbonadas.
entre 12 a 24 carbonos, las cadenas
hidrocarbonadas, corresponde a sus extremos no polares (hidrofóbico), junto a
La constante dieléctrica del agua es mayor que la de otros solventes (líquidos) con momentos
dipolares comparables, esta fuerza intrínseca, cuya acción consiste en oponerse a la atracción
Electrostática de los iones positivos y negativos de solutos polares, contribuyendo a que los puentes
de hidrógeno entre las moléculas de agua, darles la bienvenida a los orígenes de la forma, que
las estructuras formadas resisten los movimientos por el incremento en la temperatura,
por lo que, la distribución de las cargas es mucho más efectiva, así, la solubilidad de solutos polares
Se inminente bajo el principio de la constante dieléctrica; Facilitadora de la solubilidad.
estas cadenas, en sus extremos se encuentra el grupo funcional
(acido carboxílico), que corresponde a su extremo iónico polar (hidrofílico), es
precisamente este es el extremo de los puentes de hidrogeno y hace posible
La solubilidad parcial o mínima que puede tener estas sustancias.
6. ¿En qué consiste el comportamiento anfótero del agua?:
Aun cuando las sustancias anfóteras pueden ser moléculas de agua, existen mejores formas de mejorar las características de las personas y ayudar a estudiar mejor este comportamiento: las sustancias anfipróticas. Estas son las reglas que se pueden utilizar como base de datos.
Debe aclarar que todas las sustancias anfipróticas son anfóteras, pero no todas las anfóteras son anfipróticas; Existen ejemplos de que no hay protones, pero pueden comportarse como ácidos o bases de otras maneras (como por la teoría de Lewis).
Entre las sustancias anfipróticas se encuentran el agua, los aminoácidos y los iones de bicarbonato y sulfato. A su vez, las sustancias anfipróticas también se subclasifican según su capacidad de donar o ceder protones:
7. ¿Qué es una molécula anfipática?
Una molécula anfipática es una molécula que tiene partes polares y no polares. Los fosfolípidos, por ejemplo, tienen "colas" de ácidos grasos no polares y "cabezas" de fosfato polar.
El agua es un buen ejemplo de una molécula polar: su átomo de oxígeno extrae los átomos de sus hidrógenos.
Las moléculas no polares, por otro lado, no interactúan fuertemente con las moléculas polares y en realidad pueden ser empujadas por otras moléculas polares que son atraídas por las cargas parciales de las moléculas polares.
Las moléculas anfipáticas son biológicamente útiles porque pueden interactuar con sustancias polares y no polares.
8. ¿En qué consisten las interacciones hidrofóbica?.
Las interacciones hidrofóbicas (HI) son las fuerzas que mantienen la cohesión entre compuestos apolares inmersos en una solución o solvente polar. A diferencia de otras interacciones de carácter no-covalente, como los puentes de hidrógeno, las interacciones iónicas o las fuerzas de Van der Waals, las interacciones hidrofóbicas no dependen de las propiedades intrínsecas de los solutos, sino más bien de los solventes.
9. Realice una gráfica de la escala de Ph, ubique la región acida, alcalina y señale los sitios donde los ácidos y bases son fuertes y débiles.
10.Que es una solución buffer
Una solución buffer es una solución que contiene un ácido y una base. La solución se prepara tomando un ácido débil y agregando su base conjugada (que se forma al eliminar un protón del mismo tipo de ácido) o combinando una base débil con su ácido conjugado. El uso de conjugados es lo que le da a una solución buffer su resistencia a los cambios de pH; crea un equilibrio entre el ácido y la base que es difícil de superar por otros ácidos o bases. Incluso cuando se agregan ácidos o bases fuertes, el equilibrio entre el ácido / base débil y su conjugado reduce el impacto de la adición en el pH de la solución general.
Las soluciones buffer con diferentes concentraciones de iones de hidrógeno pueden prepararse variando la relación de tampón y eligiendo un ácido de fuerza intrínseca apropiada. Las soluciones tampón utilizadas comúnmente incluyen los ácidos fosfórico, cítrico o bórico y sus sales.
11. Cuál es la función de las soluciones buffer en el sistema vivo.
El almacenamiento en búfer es importante en los sistemas vivos como medio para mantener un ambiente interno bastante constante, también conocido como homeostasis. Las moléculas pequeñas, como el bicarbonato y el fosfato, proporcionan capacidad de amortiguación, al igual que otras sustancias, como la hemoglobina y otras proteínas.
Otro mecanismo más para controlar el pH de la sangre consiste en el uso de sistemas de tampón químico, que protegen contra los cambios bruscos de acidez y alcalinidad. Los sistemas de tampón de pH son combinaciones de los ácidos débiles y las bases débiles naturales del cuerpo. Estos ácidos y bases débiles existen en pares que están en equilibrio en condiciones normales de pH. Los sistemas de tampón de pH funcionan químicamente para minimizar los cambios en el pH de una solución ajustando la proporción de ácido y base.
El sistema de tampón de pH más importante en la sangre involucra ácido carbónico (un ácido débil formado por el dióxido de carbono disuelto en la sangre) y iones de bicarbonato (la base débil correspondiente)
12.Escriba la ecuación de henderson – hasselbalch; mencione cada una de sus variables.
Se puede utilizar para estimar el pH de una solución buffer. El valor numérico de la constante de disociación ácida, Ka, del ácido es una cantidad dada. El pH se calcula para valores dados de las concentraciones del ácido, HA y una sal, MA, de su base conjugada; por ejemplo, la solución puede contener ácido acético y acetato de sodio.
13.¿Qué significa máxima capacidad de un buffer y como se determina?.
Con un buffer, estás intentando maximizar tu capacidad para neutralizar el ácido o la base. La dependencia del logaritmo del pH en la relación de interés en la ecuación de Henderson-Hasselbalch es la razón por la cual el búfer funciona bien:
Ahora, su capacidad para neutralizar el ácido está determinada por la cantidad de la base conjugada A−
. Su capacidad para neutralizar la base está determinada por la cantidad de ácido HA
. Cuando la proporción entre estos es 1, tienes la misma capacidad para neutralizar cualquiera de los dos. Si está demasiado inclinado hacia un lado u otro, entonces no tendrá que ver con las especies respectivas para neutralizar el ácido o la base agregada.
14.¿Cuál es el valor del pH de la sangre humana?.
Una propiedad importante de la sangre es su grado de acidez o alcalinidad. La acidez o alcalinidad de cualquier solución, incluida la sangre, se indica en la escala de pH. La escala de pH varía de 0 (muy ácido) a 14 (muy básico o alcalino). Un pH de 7.0, en medio de esta escala, es neutro. La sangre es normalmente ligeramente básica, con un rango de pH normal de 7.35 a 7.45. Por lo general, el cuerpo mantiene el pH de la sangre cerca de 7.40.
METABOLISMO

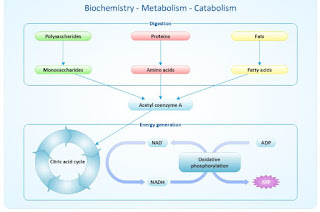
Entonces, se define el metabolismo como el conjunto de todas las reacciones químicas catalizadas por enzimas que ocurren en la célula. Es una actividad coordinada y con propósitos definidos en la que cooperan diversos sistemas multienzimaticos. En otras palabras es el proceso global que abarca la suma total de todas las reacciones enzimáticas que tienen lugar en la célula y en él participan muchos conjuntos enzimáticos mutuamente relacionados los cuales permiten el intercambio de materia y energía entre la célula y su entorno.
¿Cuál es la importancia biológica del agua?.
El agua es una sustancia de capital importancia para la vida con excepcionales propiedades consecuencia de su composición y estructura. Es una molécula sencilla formada por tres pequeños átomos, uno de oxígeno y dos de hidrógeno, con enlaces polares que permiten establecer puentes de hidrógeno entre moléculas adyacentes. Este enlace tiene una gran importancia porque confiere al agua propiedades que se corresponden con mayor masa molecular
Es una molécula sencilla formada por tres pequeños átomos, uno de oxígeno y dos de hidrógeno, con enlaces polares que permiten establecer puentes de hidrógeno entre moléculas adyacentes. Este enlace tiene una gran importancia porque confiere al agua propiedades que se corresponden con mayor masa molecular
 Es una molécula sencilla formada por tres pequeños átomos, uno de oxígeno y dos de hidrógeno, con enlaces polares que permiten establecer puentes de hidrógeno entre moléculas adyacentes. Este enlace tiene una gran importancia porque confiere al agua propiedades que se corresponden con mayor masa molecular
Es una molécula sencilla formada por tres pequeños átomos, uno de oxígeno y dos de hidrógeno, con enlaces polares que permiten establecer puentes de hidrógeno entre moléculas adyacentes. Este enlace tiene una gran importancia porque confiere al agua propiedades que se corresponden con mayor masa molecular

1. Que es una proteína
LAS PROTEINAS SON MACROMOLECULAS BIOLOGICAS MAS ABUNDABTES EN TODAS LAS CELULAS Y PARTES DE LA CELULAS Y TENEMOS A LOS AMINOACIDOS QUE SON LOS COMPONENTES BASICOS DE ESTAS PROTEINAS.
LAS CELULAS PUEDEN PRODUCIR PROTEINAS CON PROPIEDADES Y ACTIVIDADES SORPRENDENTEMENTE AL UNIR LOS 20 AMINOACIDOS EN MUCHAS COMBINACIONES Y SECUENCIAS DIFERENTES
2. Que es un aminoácido y cual es su estructura general
Los aminoácidos son:
opticamente activos tienen L y D
• Anfótero, anfiprótico: actúa como ácido o base • Iónico: electrolito• Anfolito: electrólito anfótero
Son bloques de construcción de proteínas son 20 aminoácidos comunes usados por todos los organismos.
(un gradiente de pH bajo un campo eléctrico, se mueve a su punto isoeléctrico)

En el rango de pH fisiológico (5-8), los grupos α-carboxilo y α-amino de los aminoácidos están completamente ionizados.
3. Que son isomeros ópticos y que relación tiene este concepto con la estructura de un aminoácido
Los isómeros ópticos se denominan así debido a su efecto sobre la luz polarizada plana. Las sustancias simples que muestran isomerismo óptico existen como dos isómeros conocidos como enantiómeros.
Una solución de un enantiómero gira el plano de polarización en el sentido de las agujas del reloj. Este enantiómero se conoce como la forma (+).
Por ejemplo, uno de los isómeros ópticos (enantiómeros) del aminoácido alanina se conoce como (+) alanina.
Una solución del otro enantiómero hace girar el plano de polarización en sentido contrario a las agujas del reloj. Este enantiómero se conoce como la forma (-). Así que el otro enantiómero de alanina se conoce como o (-) alanina.
Si las soluciones están igualmente concentradas, la cantidad de rotación causada por los dos isómeros es exactamente la misma, pero en direcciones opuestas.
Entonces la relación con los aminoácidos es que también tiene esa capacidad es decir que los aminoácidos también son isomeros ópticos
4. Que es y como se forma un enlace peptídico
El enlace peptídico (o enlace amida) es una de las reacciones más importantes en bioquímica, ya que es el enlace utilizado por los aminoácidos para formar proteínas
Los aminoácidos forman enlaces peptídicos con otros aminoácidos cuando el grupo amino del primer aminoácido se une con el grupo carboxilo del segundo aminoácido. Al dipéptido formado le sigue la pérdida de agua. Una cadena de aminoácidos conectados por enlaces peptídicos se denomina cadena polipeptídica, mientras que cada aminoácido individual se denomina residuo. Estas cadenas luego se pliegan debido a varias fuerzas internas y externas para convertirse en proteínas.
Los aminoácidos pueden reaccionar entre sí repetidamente para formar polímeros. La polimerización de los aminoácidos forma la base de la formación de péptidos y proteínas.Un aminoácido consiste en un grupo amino y un grupo carboxilo. Es entre estos dos grupos que la formación de enlaces peptídicos es posible.
5. Cual es la diferencia entre una proteína y un polipéptido
Las proteínas y los péptidos son componentes fundamentales de las células que desempeñan importantes funciones biológicas. Las proteínas dan forma a las células, por ejemplo, y responden a las señales transmitidas desde el entorno extracelular. Ciertos tipos de péptidos juegan un papel clave en la regulación de las actividades de otras moléculas. Estructuralmente, las proteínas y los péptidos son muy similares, ya que están formados por cadenas de aminoácidos que se mantienen unidos por enlaces peptídicos (también llamados enlaces amida). Entonces, ¿qué distingue un péptido de una proteína? Los factores distintivos básicos son el tamaño y la estructura. Los péptidos son más pequeños que las proteínas. Tradicionalmente, los péptidos se definen como moléculas que constan de entre 2 y 50 aminoácidos, mientras que las proteínas se componen de 50 o más aminoácidos. Además, los péptidos tienden a estar menos definidos en su estructura que las proteínas, que pueden adoptar conformaciones complejas conocidas como estructuras secundarias, terciarias y cuaternarias. También se pueden hacer distinciones funcionales entre péptidos y proteínas.
6. Que significa que un aminoácido sea esencial y no esencial
En primer lugar están los aminoácidos esenciales. Estos son los nueve aminoácidos que su cuerpo no puede crear por sí solo, y que usted debe obtener al comer varios alimentos. Los adultos necesitan comer alimentos que contengan los siguientes ocho aminoácidos: metionina, valina, triptófano, isoleucina, leucina, lisina, treonina y fenilalanina. La histidina, el noveno aminoácido, solo es necesaria para los bebés.
En lugar de almacenar un suministro de los ácidos esenciales, el cuerpo los utiliza para crear nuevas proteínas de forma regular. Por lo tanto, el cuerpo necesita un suministro continuo, idealmente diario, de estos aminoácidos para mantenerse saludable.
Aminoácidos no esenciales
El otro tipo es el aminoácido no esencial, 11 de los cuales existen y son sintetizados por el cuerpo. Por lo tanto, aunque son una parte importante de la construcción de proteínas, no es necesario incluirlas en una dieta diaria. Ocho de estos ácidos no esenciales también se conocen como "condicionales", lo que significa que el cuerpo puede no ser capaz de producir suficiente cantidad de ellos cuando se le presenta un estrés o enfermedad importante.
7. Escriba los nombres de los 10 aminoácido esenciales
8. Escriba los nombres de los 10 aminoácido no esenciales
9. Cual es la diferencia entre
una proteínas simple y una conjugada
La diferencia entre las proteínas simples y conjugadas son:
PROTEINAS SIMPLES
Son proteínas que en la hidrolisis solo produce aminoácidos y ocasionalmente pequeños compuestos de carbohidratos, ningún otro tipo químico
Ejemplos
*albuminas
*globulinas
*albuminoides
*histonas
*protaminas
PROTEINAS CONJUGADAS
Son proteínas que funcionan en interaccion con otros grupos químicos (no polipéptidos ) unidos por enlaces covalentes o interacciones débiles.
Estas proteínas se clasifican según la naturaleza de grupo protésico
Estas son proteínas simples combinadas con algún material no proteico en el cuerpo.
Ejemplos
*glicoproteínas
*fosfoproteínas
*hemoglobinas
*lecitoproteinas
10. ¿En el sistema celular donde se forman las proteínas? ¿como
se llama usualmente este proceso?. Realiza una descripción breve de
este proceso, ¿que relación existe con la genética humana?
ESTE PROCESO ES LAMADO SINTESIS
Las proteínas son moléculas gigantes formadas por cadenas polipeptídicas de cientos a miles de aminoácidos. Estas cadenas polipeptídicas están formadas por una veintena de tipos de aminoácidos. Un aminoácido consiste en un grupo amino básico (-NH2) y un grupo carboxilo ácido (-COOH). La diferente disposición de los aminoácidos en una cadena polipeptídica hace que cada proteína sea única.
Las proteínas son constituyentes fundamentales del protoplasma y del material de construcción de la célula.
Participan en la organización estructural y funcional de la célula. Las proteínas funcionales como las enzimas y las hormonas, controlan el metabolismo, la biosíntesis, la producción de energía, la regulación del crecimiento y las funciones sensoriales y reproductivas de la célula. Las enzimas son catalizadores en la mayoría de las reacciones bioquímicas. Incluso la expresión génica está controlada por enzimas. La replicación del ADN y la transcripción del ARN está controlada por las enzimas proteicas.
Componentes de la síntesis de proteínas:
La síntesis de proteínas se rige por la información genética contenida en los genes del
ADN de los cromosomas.
Los principales componentes de la síntesis de proteínas son:
1. ADN























No hay comentarios:
Publicar un comentario